Objetivo
El objetivo de esta práctica ha sido determinar la cantidad de acido acético que contiene el vinagre.
Material
- Matraz erlenmeyer
- Bureta
- Fenolftaleína
- Soporte
- Pipeta
- Disolución de NaOH 1molar
Ácido acético + hidróxido de sodio --> acetato de sodio + agua
Procedimiento
1) En el matraz erlenmeyer vertimos 4,5 ml de vinagre y 20ml de agua.Hechamos dos gotas de fenolftaleína.
2) Enrasamos la bureta a cero con el hidróxido de sodio (NaOH) de concentracion 1M (preparado previamente por nosotras) utilizando un embudo.
3) Añadir desde3 la bureta gota a gota la disolucion de hidróxido de sodio sobre el erlenmeyer al mismo tiempo que se agita éste para evitar que en determinado momento una zona de la disolución tenga distinta acidez que otra, hasta que sea neutralizado el vinagre, momento en el que obsrvamos un cambio de color. El final de la reacción deneutralización es cuando la fenolftaleína toma un color rosáceo.
Actividades
1) ¿A cuántos gramos de acético equivale los ml de hidróxido de sodio gastados en la práctica?
1ml........0,06
9..........x
x= 0,06 x 8 / 1 = 0,48 gramos
2) ¿Cuántos gramos de acético hay en 100 ml de vinagre?
0,48......4,5
x.........100
x= 100 x 0,48 / 4,5 = 10,6 gramos
3) ¿Cómo se obtiene el vinagre?.¿Qué es el grado de acidez del vinagre?.
Proviene de la fermentación acética del vino y manzana.
4) ¿Es beneficioso el vinagre para la salud?, ¿por qué?.
El vinagre ha sido utilizado tradicionalmente en tratamientos para combatir la angina de pecho, la artritis, el asma, la fiebre de heno, la hipertensión y todo tipo de enfermedades respiratorias, digestivas, etc. dado que depura el intestino y previene las fermentaciones del mismo.
5) La concentración del vinagre, ¿cómo debe ser?.
El vinagre contiene una concentración que va de 3% al 5% del ácido acético.
6) ¿A qué se denomina reacción de neutralización?.
Es una reacción entre un ácido y una base. Cuando en la reacción participan un ácido fuerte y na base fuerte se obtiene una sal y agua. Se puede decir que la neutralización es la combinación de cationes hidrógeno y de iones hidroxilo para formar moléculas de agua. Durante este proceso se forma una sal.
jueves, 27 de mayo de 2010
PRÁCTICA 9: Valoración redox
Introducción
Se trata de determinar la molaridad de una disolución acuosa de FeSO4 de
concentración desconocida, mediante una volumetría redox, concretamente una
permanganometría; esto es, empleando kMnO4 como oxidante.
Materiales
- Disolución de problema de sulfato de hierro(II)
- Disolución HCl
- vaso de Erlenmeyer
- Bureta
- Pipeta
- Disolución de KMnO4 a 0.1M(su preparación ha sido realizada utilizando la fórmula M=n/v; donde V es 0.01L y M es 0.1, donde nos salen los números de moles que al pasarlo a gramos nos sale 1.58g KMnO4)
Procedimiento
Se miden exactamente con una pipeta 20 c.c. de la disolución problema de sulfato de
hierro (II) y se vierten en un erlenmeyer . Se añaden unos 10 c.c. de ácido sulfúrico 1 M y se diluye todo con agua destilada hasta unos 100 c.c.
Se carga la bureta con disolución de permanganato potásico 0,1 M. Se ceba el extremo
inferior, abriendo y cerrando rápidamente la llave, y se enrasa exactamente en la
división cero.
Se va dejando caer gota a gota la disolución de la bureta en el erlenmeyer, agitando
ligeramente, hasta que el color de la disolución del erlenmeyer (amarillo débil, debido a los iones Fe3+) pase al rosa pálido (KMnO4 muy diluido). Anótese el volumen de la disolución de KMnO4 gastado. Nuestro resultado nos dio: 4,4 mL.
La molaridad nos da 0,11M y la disolucion era de 0,1M.Nuestro error ha sido de 0,01M.
La reacción redox:
1.- 2KMnO4 + 10 FeSO4 + 8 HSO4 ―――――― 2 MnSO4 + 5 Fe2(SO)4 +K2SO4+ 8 H2O
(8H+ MnO4 - + 5 e- ――> Mn2+ + 4 H2O) 2
2MnO4- + 10 Fe 2+ ―――> Mn2+ + 8 H2O + 10 Fe3+
----------------------------------------------
2MnO4 - + 10 Fe 2+ ―――> Mn2+ + 8 H2O + 10 Fe3+
Conclusión:
Esta práctica nos ha ayudado mucho por coincidir con el estudio de las reacciones de oxidación-reducción en la materia de química.

Se trata de determinar la molaridad de una disolución acuosa de FeSO4 de
concentración desconocida, mediante una volumetría redox, concretamente una
permanganometría; esto es, empleando kMnO4 como oxidante.
Materiales
- Disolución de problema de sulfato de hierro(II)
- Disolución HCl
- vaso de Erlenmeyer
- Bureta
- Pipeta
- Disolución de KMnO4 a 0.1M(su preparación ha sido realizada utilizando la fórmula M=n/v; donde V es 0.01L y M es 0.1, donde nos salen los números de moles que al pasarlo a gramos nos sale 1.58g KMnO4)
Procedimiento
Se miden exactamente con una pipeta 20 c.c. de la disolución problema de sulfato de
hierro (II) y se vierten en un erlenmeyer . Se añaden unos 10 c.c. de ácido sulfúrico 1 M y se diluye todo con agua destilada hasta unos 100 c.c.
Se carga la bureta con disolución de permanganato potásico 0,1 M. Se ceba el extremo
inferior, abriendo y cerrando rápidamente la llave, y se enrasa exactamente en la
división cero.
Se va dejando caer gota a gota la disolución de la bureta en el erlenmeyer, agitando
ligeramente, hasta que el color de la disolución del erlenmeyer (amarillo débil, debido a los iones Fe3+) pase al rosa pálido (KMnO4 muy diluido). Anótese el volumen de la disolución de KMnO4 gastado. Nuestro resultado nos dio: 4,4 mL.
La molaridad nos da 0,11M y la disolucion era de 0,1M.Nuestro error ha sido de 0,01M.
La reacción redox:
1.- 2KMnO4 + 10 FeSO4 + 8 HSO4 ―――――― 2 MnSO4 + 5 Fe2(SO)4 +K2SO4+ 8 H2O
(8H+ MnO4 - + 5 e- ――> Mn2+ + 4 H2O) 2
2MnO4- + 10 Fe 2+ ―――> Mn2+ + 8 H2O + 10 Fe3+
----------------------------------------------
2MnO4 - + 10 Fe 2+ ―――> Mn2+ + 8 H2O + 10 Fe3+
Conclusión:
Esta práctica nos ha ayudado mucho por coincidir con el estudio de las reacciones de oxidación-reducción en la materia de química.

PRÁCTICA 8: Reacciones de neutralización
Introducción:
El objetivo de esta práctica ha sido hallar una relación que nos ha permitido conocer los mililitros de NaOH necesarios para neutralizar una cantidad determinada de HCl.
Material:
- Matraz Erlenmeyer
- Bureta
- Pipeta
- Trípode y pinza
- Fenolftaleína
- Disolución diluida de hidróxido de sodio
- Disolución diluida de acido clorhídrico
- Aspirador de pipeta
Desarrollo:
Preparamos las dos disoluciones a partir de los siguientes datos:
Disolución de HCl
0,05 M
1 L
Densidad = 1190 g/L
37% riqueza
Cálculo del volumen de la disolución diluida:
1190 x 37/100 x 1 mol/ 36,5 g = 12,06 M
Md x Vd = Mc x Vc ; 12,06 x Vd = 0,05 x 1000 ; Vd = 4,14 ml
Disolución de NaOH
0,1 M
1 L
Cálculo de la masa de NaOH de la disolución:
M = nº de moles / volumen; nº moles = M x V ; nº moles = 0,1 x 1 ; nº moles = 0,1 moles NaOH
0,1 moles de NaOH x 40 g/ 1 mol = 4 g NaOH
Después de prepararlas:
1. Llenamos una bureta con agua y comprobamos su correcto funcionamiento. A continuación la vaciamos y la llenamos hasta la graduación superior con la disolución de NaOH.
2. Utilizando una pipeta echamos 5ml de la disolución de HCl en un matraz Erlenmeyer.
3. Añadimos dos gotas de fenoftaleína a la disolución del matraz lo colocamos debajo de la bureta.
4. Gota a gota, dejamos caer la disolución de NaOH sobre la de HCl, agitando el matraz, hasta que la disolución adquiera un color rosado. Medimos los ml de disolución que ha sido necesario añadir y los anotamos.
5. Vaciamos el matraz y repetimos el experimento con 10, 15, 20, 25, 30, y 35 ml de HCl. Los resultados obtenidos fueron los siguientes:
5ml HCl -> 3ml NaOH
10ml HCl -> 5'6ml NaOH
15ml HCl -> 8’2ml NaOH
20ml HCl -> 10'5ml NaOH
25ml HCl -> 13'6ml NaOH
30ml HCl -> 15’8ml NaOH
35ml HCl -> 18ml NaOH
6. Dibujamos una gráfica con los datos obtenidos:

Actividades:
a) ¿Cuántos mililitros de la disolución de NaOH habría que añadir para que reaccionaran con 80ml de HCl?
MaVa=MbVb;
0'05 • 0'08 = 0'1 • Vb; Vb = 0'04L = 40ml.
b) ¿Y con 200ml?. ¿Y con 1L?
->200ml: 0'05 • 0'2 = 0'1 • Vb; Vb = 0'1L = 100ml.
-> 1L: 0'05 • 1= 0'1 • Vb; Vb = 0'5L = 500mL.
e) ¿Por qué se utiliza la fenoftaleína?
Porque se trata de un indicador que cambia de color cuando pasa de estar en medio ácido a estar en un medio básico.
Conclusión:
Ha sido interesante porque es curioso hallar la cantidad necesaria para neutralizar una disolución. Además, hemos recordado las reacciones de neutralización.
El objetivo de esta práctica ha sido hallar una relación que nos ha permitido conocer los mililitros de NaOH necesarios para neutralizar una cantidad determinada de HCl.
Material:
- Matraz Erlenmeyer
- Bureta
- Pipeta
- Trípode y pinza
- Fenolftaleína
- Disolución diluida de hidróxido de sodio
- Disolución diluida de acido clorhídrico
- Aspirador de pipeta
Desarrollo:
Preparamos las dos disoluciones a partir de los siguientes datos:
Disolución de HCl
0,05 M
1 L
Densidad = 1190 g/L
37% riqueza
Cálculo del volumen de la disolución diluida:
1190 x 37/100 x 1 mol/ 36,5 g = 12,06 M
Md x Vd = Mc x Vc ; 12,06 x Vd = 0,05 x 1000 ; Vd = 4,14 ml
Disolución de NaOH
0,1 M
1 L
Cálculo de la masa de NaOH de la disolución:
M = nº de moles / volumen; nº moles = M x V ; nº moles = 0,1 x 1 ; nº moles = 0,1 moles NaOH
0,1 moles de NaOH x 40 g/ 1 mol = 4 g NaOH
Después de prepararlas:
1. Llenamos una bureta con agua y comprobamos su correcto funcionamiento. A continuación la vaciamos y la llenamos hasta la graduación superior con la disolución de NaOH.
2. Utilizando una pipeta echamos 5ml de la disolución de HCl en un matraz Erlenmeyer.
3. Añadimos dos gotas de fenoftaleína a la disolución del matraz lo colocamos debajo de la bureta.
4. Gota a gota, dejamos caer la disolución de NaOH sobre la de HCl, agitando el matraz, hasta que la disolución adquiera un color rosado. Medimos los ml de disolución que ha sido necesario añadir y los anotamos.
5. Vaciamos el matraz y repetimos el experimento con 10, 15, 20, 25, 30, y 35 ml de HCl. Los resultados obtenidos fueron los siguientes:
5ml HCl -> 3ml NaOH
10ml HCl -> 5'6ml NaOH
15ml HCl -> 8’2ml NaOH
20ml HCl -> 10'5ml NaOH
25ml HCl -> 13'6ml NaOH
30ml HCl -> 15’8ml NaOH
35ml HCl -> 18ml NaOH
6. Dibujamos una gráfica con los datos obtenidos:

Actividades:
a) ¿Cuántos mililitros de la disolución de NaOH habría que añadir para que reaccionaran con 80ml de HCl?
MaVa=MbVb;
0'05 • 0'08 = 0'1 • Vb; Vb = 0'04L = 40ml.
b) ¿Y con 200ml?. ¿Y con 1L?
->200ml: 0'05 • 0'2 = 0'1 • Vb; Vb = 0'1L = 100ml.
-> 1L: 0'05 • 1= 0'1 • Vb; Vb = 0'5L = 500mL.
e) ¿Por qué se utiliza la fenoftaleína?
Porque se trata de un indicador que cambia de color cuando pasa de estar en medio ácido a estar en un medio básico.
Conclusión:
Ha sido interesante porque es curioso hallar la cantidad necesaria para neutralizar una disolución. Además, hemos recordado las reacciones de neutralización.
martes, 25 de mayo de 2010
PRÁCTICA 7: Utilización de los indicadores ácido-base
Introducción
El desarrollo de esta práctica nos ha permitido diseñar un modelo sobre el comportamiento de diferentes indicadores ácido-base, que son sustancias que, en función del pH de una disolución, experimentan cambios en su composición.
Materiales
- Gradilla
- Dos pipetas
- Cuentagotas o varilla de vidrio
- Diez tubos de ensayo
- Dos matraces
Desarrollo de la práctica
1. Limpiamos cinco pares de tubos de ensayos, ya que vamos a probar cinco indicadores.
2. Añadimos en la mitad de ellos 2ml de ácido clorhídrico HCL diluido, y en la otra mitad 2ml de hidróxido de sodio NaOH diluido, con las pipetas.
3. Echamos dos gotas del primer indicador en el primer par (uno con ácido y otro con base), repitiéndolo con el siguiente indicador y los siguientes tubos de ensayo, y así sucesivamente.
En el último caso utilizamos papel de tornasol. Anotamos todas las coloraciones obtenidas y los resultados fueron los siguientes:
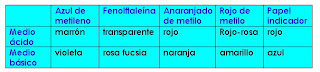
Actividades
1. Explica lo que ocurre e indica qué es un indicador ácido-base.
Dependiendo de la disolución (acida o básica), ésta ha adquirido un color u otro gracias al indicador. Dependiendo del color adquirido, podemos deducir el pH de la disolución.
2. ¿Cómo se define el pH de una disolución?
El pH es una medida de la acidez o alcalinidad de una solución. El pH indica la concentración de iones hidronio [H3O+] presentes en determinadas sustancias. El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más protones en la disolución) , y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (donde el disolvente es agua).
3. ¿Qué pH debe tener el champú utilizado por los niños?
Un pH neutro, es decir, pH 7. esto es debido a la delicada piel de los niños.
4. ¿Cuántas clases de indicadores conoces?
Cinco, los utilizados en esta práctica.
5. ¿Qué es el papel de tornasol (indicador universal)?
El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece sólo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleína.
Conclusión
Nos ha gustado mucho esta práctica por trabajar por primera vez con indicadores. Ver el cambio de color que experimentan las disoluciones ha sido muy curioso.

El desarrollo de esta práctica nos ha permitido diseñar un modelo sobre el comportamiento de diferentes indicadores ácido-base, que son sustancias que, en función del pH de una disolución, experimentan cambios en su composición.
Materiales
- Gradilla
- Dos pipetas
- Cuentagotas o varilla de vidrio
- Diez tubos de ensayo
- Dos matraces
Desarrollo de la práctica
1. Limpiamos cinco pares de tubos de ensayos, ya que vamos a probar cinco indicadores.
2. Añadimos en la mitad de ellos 2ml de ácido clorhídrico HCL diluido, y en la otra mitad 2ml de hidróxido de sodio NaOH diluido, con las pipetas.
3. Echamos dos gotas del primer indicador en el primer par (uno con ácido y otro con base), repitiéndolo con el siguiente indicador y los siguientes tubos de ensayo, y así sucesivamente.
En el último caso utilizamos papel de tornasol. Anotamos todas las coloraciones obtenidas y los resultados fueron los siguientes:

Actividades
1. Explica lo que ocurre e indica qué es un indicador ácido-base.
Dependiendo de la disolución (acida o básica), ésta ha adquirido un color u otro gracias al indicador. Dependiendo del color adquirido, podemos deducir el pH de la disolución.
2. ¿Cómo se define el pH de una disolución?
El pH es una medida de la acidez o alcalinidad de una solución. El pH indica la concentración de iones hidronio [H3O+] presentes en determinadas sustancias. El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7 (el valor del exponente de la concentración es mayor, porque hay más protones en la disolución) , y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (donde el disolvente es agua).
3. ¿Qué pH debe tener el champú utilizado por los niños?
Un pH neutro, es decir, pH 7. esto es debido a la delicada piel de los niños.
4. ¿Cuántas clases de indicadores conoces?
Cinco, los utilizados en esta práctica.
5. ¿Qué es el papel de tornasol (indicador universal)?
El tornasol es uno de los más conocidos indicadores de pH. Suministrado en una solución o tintura violeta normalmente, se torna de color rojo-anaranjado en contacto con compuestos ácidos, debajo de un índice de pH de 4,5 (de ahí su nombre) y oscurece sólo ligeramente con los alcalinos (por encima de un pH de 8,5), por lo que a veces suele emplearse tornasol al que se le ha añadido ácido clorhídrico para identificar bases. Su uso ha decaído en los últimos años debido a la perfección del indicador universal y de la fenolftaleína.
Conclusión
Nos ha gustado mucho esta práctica por trabajar por primera vez con indicadores. Ver el cambio de color que experimentan las disoluciones ha sido muy curioso.

PRÁCTICA 6: Densidad de un gas
Introducción
El objetivo de esta práctica es determinar la densidad de una muestra gaseosa a partir del conocimiento su masa y el volumen de agua desplazado por dicho cuerpo, recordando así el concepto de densidad.
Materiales
- Matraz Erlenmeyer
- Aspirina efervescente
- Probeta mediana
- Cristalizador
- Tubo de goma y al final un tubo de vidrio con un tapón de corcho
- Peso
Desarrollo de la práctica
1. En un matraz Erlenmeyer colocamos 20 ml de agua. Se pesa el matraz erlenmeyer con la mitad de la aspirina efervescente. Anotamos la masa total obtenida.
2. Tras haber llenado la probeta mediana con agua, la invertimos sobre el cristalizador (con agua, aproximadamente hasta la mitad).
3. Anotamos la señal de agua en la probeta e introducimos con mucho cuidado el tubo de goma que desemboca en un tubo de vidrio con un tapón de corcho.
4. Se echa la media pastilla de aspirina efervescente dentro del matraz erlenmeyer y se tapa con el tubo de goma que termina en el tubo de vidrio y en el tapón de corcho. El gas de la pastilla efervescente comienza a pasar a la probeta y el nivel de agua baja.
5. Cuando dejen de salir burbujas del gas, anotamos la señal de la probeta y, por la diferencia obtenemos el volumen del gas liberado en el proceso.
6. Pesamos otra vez el Erlenmeyer, obteniendo por diferencia la masa del gas liberado. Dividiendo esta masa entre el volumen calculado anteriormente hallamos la densidad del gas:
Masa del Erlenmeyer + agua + pastilla : 131'3g
Volumen del gas liberado: 82ml
Masa Erlenmeyer + agua + restos de la pastilla: 130'1g
Masa del gas liberado: 1'04g
Densidad del gas: 0'013 g/ml
Actividades
1. ¿Cuál puede ser la naturaleza del gas?
La naturaleza del gas, debido a la composición de la pastilla efervescente, sabemos que es CO2.
2. ¿Qué reacción ocurre entre la pastilla y el agua?
CaCO3 + H2O -> CaO + H2CO3 ( CO2 + H2O)
3. ¿ De qué factores depende la densidad de un gas?
De la temperatura y la presión.
Conclusión
Ha sido una práctica muy entretenida y nos ha llamado la atención, sobre todo, la forma de hacerlo, montando el mecanismo simplemente con un matraz erlenmeyer, una probeta, un tubo y un cristalizador.

El objetivo de esta práctica es determinar la densidad de una muestra gaseosa a partir del conocimiento su masa y el volumen de agua desplazado por dicho cuerpo, recordando así el concepto de densidad.
Materiales
- Matraz Erlenmeyer
- Aspirina efervescente
- Probeta mediana
- Cristalizador
- Tubo de goma y al final un tubo de vidrio con un tapón de corcho
- Peso
Desarrollo de la práctica
1. En un matraz Erlenmeyer colocamos 20 ml de agua. Se pesa el matraz erlenmeyer con la mitad de la aspirina efervescente. Anotamos la masa total obtenida.
2. Tras haber llenado la probeta mediana con agua, la invertimos sobre el cristalizador (con agua, aproximadamente hasta la mitad).
3. Anotamos la señal de agua en la probeta e introducimos con mucho cuidado el tubo de goma que desemboca en un tubo de vidrio con un tapón de corcho.
4. Se echa la media pastilla de aspirina efervescente dentro del matraz erlenmeyer y se tapa con el tubo de goma que termina en el tubo de vidrio y en el tapón de corcho. El gas de la pastilla efervescente comienza a pasar a la probeta y el nivel de agua baja.
5. Cuando dejen de salir burbujas del gas, anotamos la señal de la probeta y, por la diferencia obtenemos el volumen del gas liberado en el proceso.
6. Pesamos otra vez el Erlenmeyer, obteniendo por diferencia la masa del gas liberado. Dividiendo esta masa entre el volumen calculado anteriormente hallamos la densidad del gas:
Masa del Erlenmeyer + agua + pastilla : 131'3g
Volumen del gas liberado: 82ml
Masa Erlenmeyer + agua + restos de la pastilla: 130'1g
Masa del gas liberado: 1'04g
Densidad del gas: 0'013 g/ml
Actividades
1. ¿Cuál puede ser la naturaleza del gas?
La naturaleza del gas, debido a la composición de la pastilla efervescente, sabemos que es CO2.
2. ¿Qué reacción ocurre entre la pastilla y el agua?
CaCO3 + H2O -> CaO + H2CO3 ( CO2 + H2O)
3. ¿ De qué factores depende la densidad de un gas?
De la temperatura y la presión.
Conclusión
Ha sido una práctica muy entretenida y nos ha llamado la atención, sobre todo, la forma de hacerlo, montando el mecanismo simplemente con un matraz erlenmeyer, una probeta, un tubo y un cristalizador.

lunes, 7 de diciembre de 2009
Prácticas 4 y 5. VELOCIDAD DE LAS REACCIONES QUÍMICAS
El objetivo de esta práctica consiste en medir de reacciones químicas, la velocidad con la que desaparecen los reactivos y se forman los productos.
Materiales utilizados:
- Vidrio de reloj
- Reloj
- 2 vasos de precipitado
- Triosulfato de sodio
- Balanza
- Probeta
- Pipeta y su aspirador
- Disolución de ácido clorhídrico
Procedimiento:
Trabajamos con la siguiente reacción: S2O3Na2 + 2 ClH ---> S + SO2 + 2 ClNa + H2O
1. En primer lugar preparamos dos disoluciones 1M: una de HCl y otra de tiosulfato de sodio, con las que posteriormente vamos a trabajar.
2. Tras esto, disolvemos 2g de tiosulfato en 50mL de agua.
3. Después, hemos dibujado en un papel de filtro una cruz de un color fuerte, para colocar encima el vaso de precipitado en que vertiremos la disolución. Cuando no veamos la cruz, es porque ya ha finalizado la reacción.
4. Se vierten en el vaso 25ml de disolución de tiosulfato que hemos medido con una probeta.
5. Después, tomamos 3ml de disolución de HCl y los vertimos en el vaso con tiosulfato.
6. Finalmente, cronometramos el tiempo desde que vertimos el HCl hasta que se enturbia, impidiendo ver la cruz dibujada en el papel.
7.-Se repite la experiencia con el resto de tiosulfato.
V1=0,8/5,52=0,145
V2=0,7/4,96=0,141
V= (V1+V2)/2;
V= 0,286/2= 0,143
Actividades:
1. El olor desagradable que produce la reacción es debido a la aparición del dióxido de azufre.
2. El color amarillo de la reacción es debido a la aparición del azufre.
Conclusión:
Esta práctica me ha gustado bastante. Me ha llamado especialmente la atención la velocidad en la que se ha producido la reacción. Además, hemos visto el olor tan desagradable que pueden causar algunas sustancias, y el cambio de color que pueden experimentar.
Materiales utilizados:
- Vidrio de reloj
- Reloj
- 2 vasos de precipitado
- Triosulfato de sodio
- Balanza
- Probeta
- Pipeta y su aspirador
- Disolución de ácido clorhídrico
Procedimiento:
Trabajamos con la siguiente reacción: S2O3Na2 + 2 ClH ---> S + SO2 + 2 ClNa + H2O
1. En primer lugar preparamos dos disoluciones 1M: una de HCl y otra de tiosulfato de sodio, con las que posteriormente vamos a trabajar.
2. Tras esto, disolvemos 2g de tiosulfato en 50mL de agua.
3. Después, hemos dibujado en un papel de filtro una cruz de un color fuerte, para colocar encima el vaso de precipitado en que vertiremos la disolución. Cuando no veamos la cruz, es porque ya ha finalizado la reacción.
4. Se vierten en el vaso 25ml de disolución de tiosulfato que hemos medido con una probeta.
5. Después, tomamos 3ml de disolución de HCl y los vertimos en el vaso con tiosulfato.
6. Finalmente, cronometramos el tiempo desde que vertimos el HCl hasta que se enturbia, impidiendo ver la cruz dibujada en el papel.
7.-Se repite la experiencia con el resto de tiosulfato.
Primera experiencia:
V1=0,8/5,52=0,145
Segunda experiencia:
V2=0,7/4,96=0,141
Media:
V= (V1+V2)/2;
V= 0,286/2= 0,143
Actividades:
1. El olor desagradable que produce la reacción es debido a la aparición del dióxido de azufre.
2. El color amarillo de la reacción es debido a la aparición del azufre.
Conclusión:
Esta práctica me ha gustado bastante. Me ha llamado especialmente la atención la velocidad en la que se ha producido la reacción. Además, hemos visto el olor tan desagradable que pueden causar algunas sustancias, y el cambio de color que pueden experimentar.
Práctica 3: COMPROBACIÓN DE LA LEY DE LAVOISIER O LEY DE CONSERVACIÓN DE LA MASA
El objetivo de esta práctica es comprobar que en una reacción química la cantidad de materia de antes y después permanece constante.
Materiales utilizados:
- Dos vasos de precipitado
- Dos matraces de 50 ml aforado
- Embudo
- Balanza
- Vidrio de reloj
- Nitrato de plomo
- Varilla
- Yoduro de potasio
Procedimiento de la práctica:
Primera parte:
Se preparan las dos disoluciones, de nitrato de plomo y yoduro de potasio, siguiendo el mismo método que en la práctica anterior.
Segunda parte:
Masa vaso A: 45,2g
Masa vaso B: 44,7g
Masa vaso A + nitrato de plomo: 96,1g
Masa vaso B + yoduro de potasio: 95,4g
Diferencia entre las masas iniciales y finales:
A: 96,1-45,2= 50,9
B: 95,4-44,5= 50,7
Mezclamos las dos disoluciones y las pesamos en la balanza: 146,2
Se le resta el peso del vaso B (que es con el que nos hemos quedado al final para mezclarlo todo) 146,2-44,7=101,5 g
Sumamos las masas de los reactivos para ver el error cometido en la práctica: 50,9+50,7=101,6
El error cometido es de 101,6 – 101,5 = 0,1
Vaso A vacío: 45,2 g
Vaso B vacío: 44,8 g
Masa A + nitrato de plomo: 96,1g
Masa B + yoduro de potasio: 95,6
Diferencia entre las masas iniciales y finales:
A: 96,1-45,2= 50,9
B: 95,6-44,8= 50,8
Mezclamos las dos disoluciones y las pesamos en la balanza: 146,4
Se le resta el peso del vaso B (que es con el que nos hemos quedado al final para mezclarlo todo) 146,4-44,8=101,6 g
Sumamos las masas de los reactivos para ver el error cometido en la práctica: 50,9+50,7=101,6
El error cometido es de 101,6 – 101,6 = 0 (No hay error)
Conclusión:
Esta práctica nos ha demostrado que la ley de conservación de la masa realmente se cumple. Me ha parecido bastante interesante ya que hemos comprobado algo estudiado anteriormente, y de esta forma se entiende todo mejor.
Materiales utilizados:
- Dos vasos de precipitado
- Dos matraces de 50 ml aforado
- Embudo
- Balanza
- Vidrio de reloj
- Nitrato de plomo
- Varilla
- Yoduro de potasio
Procedimiento de la práctica:
Primera parte:
Se preparan las dos disoluciones, de nitrato de plomo y yoduro de potasio, siguiendo el mismo método que en la práctica anterior.
Segunda parte:
Primer experimento:
Masa vaso A: 45,2g
Masa vaso B: 44,7g
Masa vaso A + nitrato de plomo: 96,1g
Masa vaso B + yoduro de potasio: 95,4g
Diferencia entre las masas iniciales y finales:
A: 96,1-45,2= 50,9
B: 95,4-44,5= 50,7
Mezclamos las dos disoluciones y las pesamos en la balanza: 146,2
Se le resta el peso del vaso B (que es con el que nos hemos quedado al final para mezclarlo todo) 146,2-44,7=101,5 g
Sumamos las masas de los reactivos para ver el error cometido en la práctica: 50,9+50,7=101,6
El error cometido es de 101,6 – 101,5 = 0,1
Segundo experimento:
Vaso A vacío: 45,2 g
Vaso B vacío: 44,8 g
Masa A + nitrato de plomo: 96,1g
Masa B + yoduro de potasio: 95,6
Diferencia entre las masas iniciales y finales:
A: 96,1-45,2= 50,9
B: 95,6-44,8= 50,8
Mezclamos las dos disoluciones y las pesamos en la balanza: 146,4
Se le resta el peso del vaso B (que es con el que nos hemos quedado al final para mezclarlo todo) 146,4-44,8=101,6 g
Sumamos las masas de los reactivos para ver el error cometido en la práctica: 50,9+50,7=101,6
El error cometido es de 101,6 – 101,6 = 0 (No hay error)
Conclusión:
Esta práctica nos ha demostrado que la ley de conservación de la masa realmente se cumple. Me ha parecido bastante interesante ya que hemos comprobado algo estudiado anteriormente, y de esta forma se entiende todo mejor.
Suscribirse a:
Entradas (Atom)
